abcsite.free.fr
![]()
Chimie Organique
|
|
9. Aromaticité: Le benzène et ses dérivés
Dans ce chapitre nous aborderons les molécules aromatiques et leurs derivés.
| Dans ce chapitre | |
| 9.1. | Nomenclature |
| 9.2. | L’aromaticité |
| 9.3. | Arènes (hydrocarbures aromatiques), le cycle benzénique |
| 9.4. | Benzènes substitués |
| Modèles Moléculaires en format .pdb: Aromatiques | |
| 9.5. | Note de nomenclature |
| 9.6. | Le biphényle et ses dérivés |
| 9.7. | Systèmes polycycliques |
| 9.8. | Règle de Hückel |
| 9.9. | Hétérocycles aromatiques |
| 9.10. | Exercices de nomenclature |
Les arènes sont les hydrocarbures dont la forme dérive de celle du benzène:
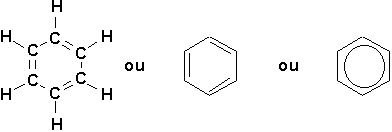
C’est Friedrich August Kekulé qui suggéra en 1865 la structure la plus probable du benzène, un composé de formule C6H6 obtenu par pyrolyse de l’huile de baleine en 1825 par Michael Faraday [Note]. C’est un produit hautement insaturé, mais qui est totalement dénué de la réactivité habituelle observée chez les alcènes ordinaires. Sa structure ne fut définitivement élucidée qu’en 1931. On sait maintenant que le benzène possède deux (2) formes de résonance équivalentes du cyclohexatriène.
Dans le cas des cycles benzéniques, que nous verrons en détails plus tard, il convient de mentionner que toutes les liaisons entourant les atomes de carbone possèdent un angle de 120°. Ceci implique que la molécule est plane. Une grande partie des propriétés physico-chimiques de cette classe de composés découle directement de ce fait.
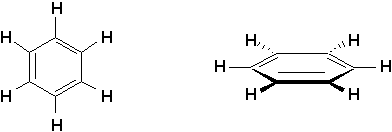
On les appelle aussi des hydrocarbures aromatiques. Anciennement, cela avait rapport à leur odeur prononcée, mais maintenant le terme aromatique a évolué et fait référence aux caractéristiques physico-chimiques spéciales du cycle benzénique.
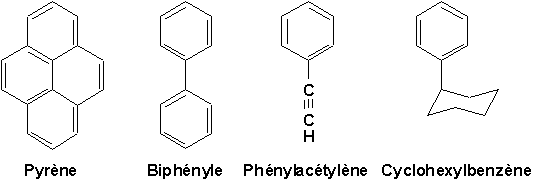
Ces molécules contiennent au moins un cycle (ou noyau) benzénique. Nous verrons qu’elles peuvent en comporter plusieurs, liés par un côté commun (pyrène), leur sommets (biphényle), et comporter des chaînes aliphatiques latérales (phénylacétylène et cyclohexylbenzène).
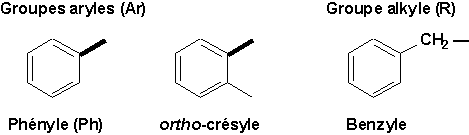
L’enlèvement d’un hydrogène porté par un carbone du cycle fournit un groupe aryle (symbole Ar). L’enlèvement d’un hydrogène porté par un carbone d’une chaîne latérale fournit un groupe alkyle (symbole R).
Il importe ici de définir pour les besoins de nomenclature les positions occupées par les différents substituants sur le cycle benzénique:
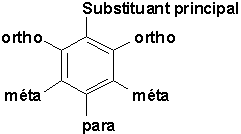
9.1. Nomenclature (Vollhardt 15.1)
La nomenclature des composés benzéniques est décrite dans Favre dans le chapitre des carbocycles MADONC (chapitre 6.2), des hétérocycles (chapitre 6.4) et des cycles fonctionnalisés (chapitre 7).
9.2. L’aromaticité (Vollhardt 15.2)
La Figure 15.1 (Vollhardt p.553) montrent la représentation des liaisons dans le benzène. On y voit clairement le squelette
s, de même que les nuages d’électrons p.On peut voir que les 6 électrons
p sont délocalisés sur les 6 liaisons. Il en résulte une stabilisation accrue de la molécule qui porte le nom de résonance.On représente le benzène comme suit:
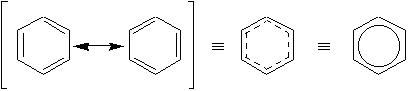
Ceci résulte de notre incapacité à décrire correctement la molécule. La véritable représentation de benzène est liée aux formules de Kekulé, mais différentes de celles-ci. On dit que le benzène est un hybride de résonance.
La Figure 15.2 (p.554) montre clairement que les valeurs expérimentales des longueurs de liaisons carbone-carbone sont toutes égales (1.39Å) et intermédiaires entre celle de la liaison double ordinaire (1.33 Å) et celle de la liaison simple (1.53 Å).
On peut mesurer la valeur de cette énergie de résonance à l’aide des chaleurs d’hydrogénations. On le fait en comparant la chaleur libérée par l’hydrogénation du cyclohexène, avec celle libérée par le cyclohexa-1,3-diène (en tenant compte de la stabilisation de résonance d’un diène conjugué) et celle du cyclohexa-1,3,5-triène hypothétique (en tenant compte de la stabilisation de résonance d’un triène conjugué). Ces calculs sont ensuite comparés aux valeurs expérimentales (Figure 15.3, Vollhardt p.555). On constate qu’il existe une grande différence entre les valeurs calculée et expérimentale pour le benzène. Cette différence est ce que nous appelons l’énergie de résonance. On emploie aussi les termes énergie de délocalisation, stabilisation aromatique, aromaticité.
Les orbitales moléculaires du benzène sont intéressantes parce que, à cause de la symétrie de la molécule, elles existent en deux paires d’orbitales dégénérées (
y2,3 et y4,5, Figure 15.4, Vollhardt p.556). Ainsi, lorsque l’on remplie les orbitales moléculaires (Figure 15.5, Vollhardt p.557), on voit clairement la provenance de cette énergie de résonance qui stabilise grandement la molécule.Ce type d’arrangement des orbitales est important à retenir, car il est à la base de la règle de Hückel que nous verrons plus loin.
9.3. Arènes (hydrocarbures aromatiques), le cycle benzénique (Arnaud 12)
9.3.1. Caractères Physiques (Arnaud 12-1)
Les arènes sont des liquides ou des solides à température ambiante (benzène: F5,5°C, Eb 80°C). Ils sont insolubles dans l’eau. Les termes liquides, comme le benzène et le toluène sont d’excellent solvants pour de nombreuses substances organiques comme les corps gras et les caoutchoucs.
Ils possèdent souvent une odeur très marquée. Les arômes naturelles comme les essences de vanille, d’anis, de cumin, de thym possèdent une structure benzénique associée à d’autres fonctions.
9.3.2. Caractéristiques spectrales (Vollhardt 15.4)
Le cycle benzénique absorbe dans l’ultraviolet vers 255-270 nm (
e = 250 @ 350). Les spectres U.V.-Visibles des composés aromatiques se modifient de manière caractéristique lorsque des substituants sont introduits dans ces molécules; ce qui a mené à la synthèse d’une foule de colorants.Certains composés, comme l’acide 4-aminobenzènecarboxilique (ou acide para-aminobenzènecarboxilique, PABA), p-H2N—C6H4—COOH qui est hydrosoluble présente un
lmax à 289 nm et un coefficient d’extinction élevé de 18600. Étant non toxique, il est utilisé comme écran solaire vis-à-vis des radiations ultraviolettes dangereuses du soleil.Dans l’infrarouge, le noyau benzénique présente des bandes caractéristiques vers 3000-3100 cm-1 (C—H), 1500-2000 cm-1 (C—C aromatique) et entre 650 et 1000cm-1 (déformations angulaires hors du plan des C—H). Ces dernières varient selon le degré de substitution du cycle aromatique (Figure 15.7, Vollhardt p.560).
En RMN-13C, les valeurs de
d sont semblables à ce qui est observé pour les carbones alcéniques analogues (120 à 135 ppm). Les noyaux qui sont substitués par des groupes alkyles résonnent à des champs plus faibles, alors que les groupes polaires peuvent les déplacer dans l’une ou l’autre direction.En RMN-1H, les protons du cycle sont très déblindés et apparaissent entre
d 6,5 et 8,5ppm, ce qui est plus bas que les hydrogènes alcéniques (d 4.6-5.7 ppm). Dans le cas du benzène, on n’observe qu’un singulet à 7.27 ppm. La raison de ce déblindage est que les électrons p délocalisés sont très polarisables, ce qui provoque une circulation des e- autour du cycle, comme dans une bobine. Cette circulation crée un champ induit qui augmente le champ local, par rapport à Ho et déblinde les noyaux (Figure 15.8, Vollhardt p.560).La Figure 15.9 (Vollhardt p.561) montre le RMN-1H du bromobenzène. On peut voir que les hydrogènes des positions ortho, méta et para par rapport au substituant sont spectroscopiquement différents. Ils posséderont des déplacement chimiques différents et seront couplés. Un groupement plus électroattracteur, comme le chlore, induira encore plus de différence.
Certains substituants, par exemple les chaînes alkyles, ne perturbent pas les déplacements chimiques des hydrogènes benzéniques. Citons notamment le toluène (nom conservé du méthylbenzène), C6H5—CH#. Il possède un singulet (A=5) à
d7.17 ppm et un second singulet (A=3) à d 2.34 ppm. En principe, les protons aromatiques ne devraient pas être équivalents, mais en pratique, ils le sont et ne sont donc pas couplés, comme c’est souvent le cas des protons aromatiques et apparaissent sous la forme d’un singulet élargi. Cela est exceptionnel et les dérivés substitués donnent des spectres beaucoup plus compliqués.| À partir d’ici, l’étudiant intéressé à comprendre plus en profondeur les influences des substitutions aromatiques sur les spectres 1H-RMN est fortement invité à utiliser les logiciels disponibles au département de chimie et sur le Web (voir les liens à http://crpp0001.uqtr.ca/Chimie.html |
Nous présenterons ici les spectres simulés (ACD/HNRM, Windows95) de divers composés benzéniques différemment substitués. Nous en tirerons ensuite certaines conclusions.
Chlorobenzène
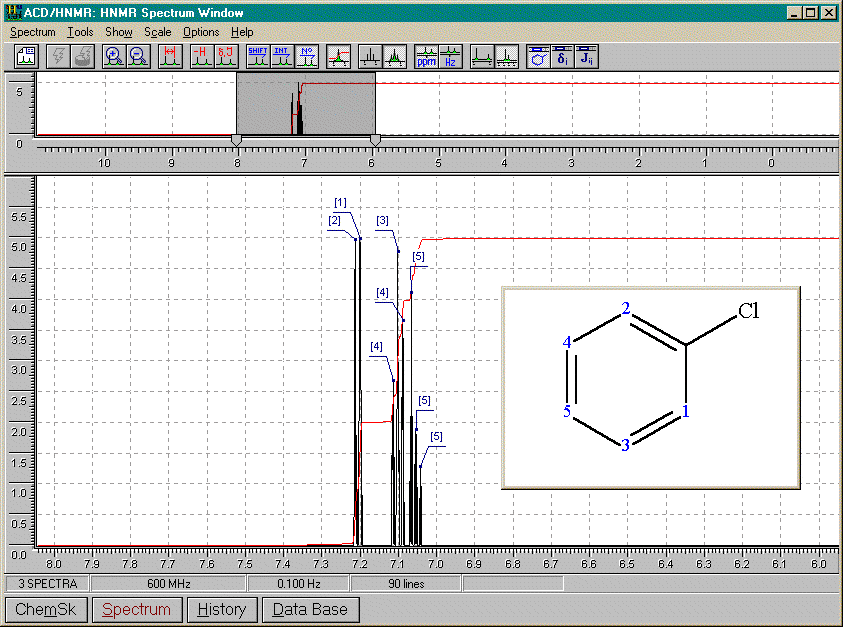
1,2-dichlorobenzène
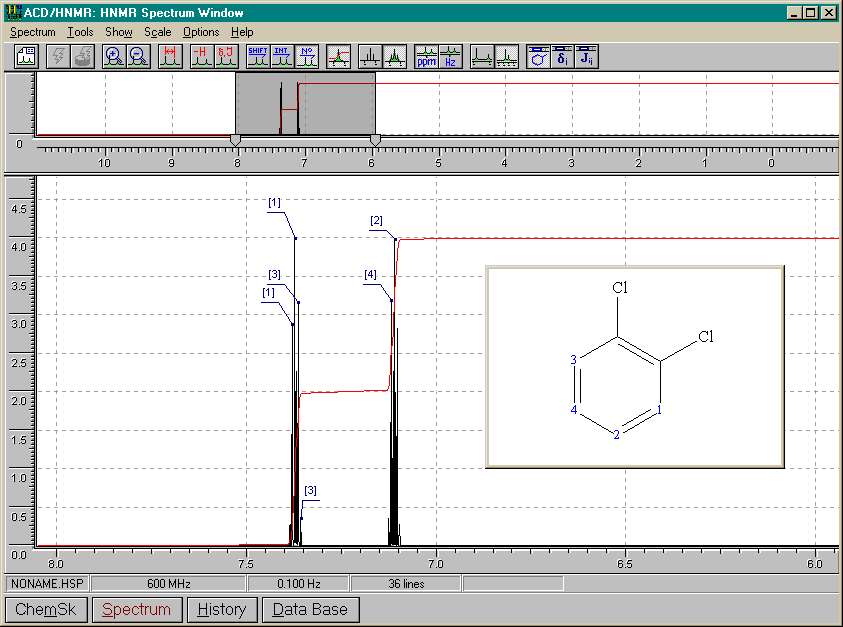
1,4-dichlorobenzène
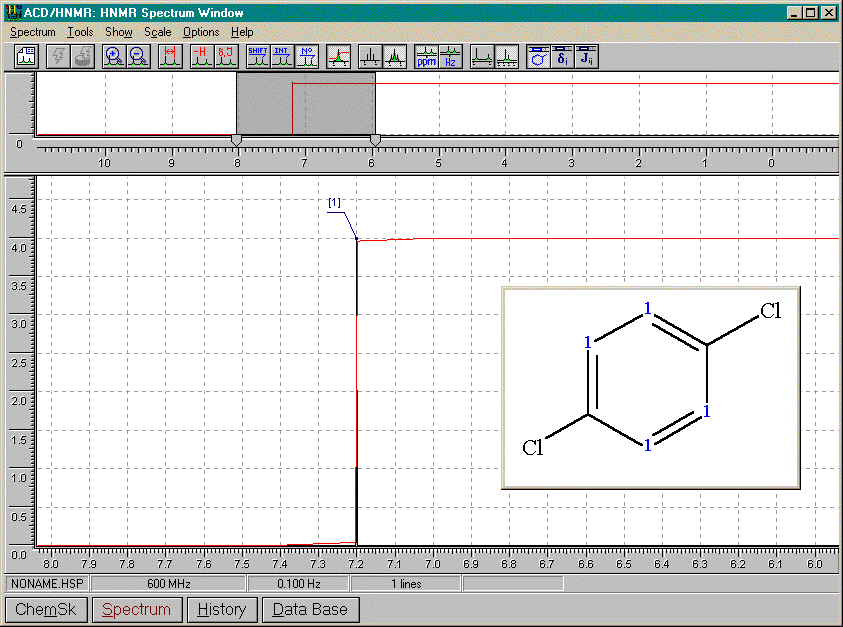
1,3-dichlorobenzène
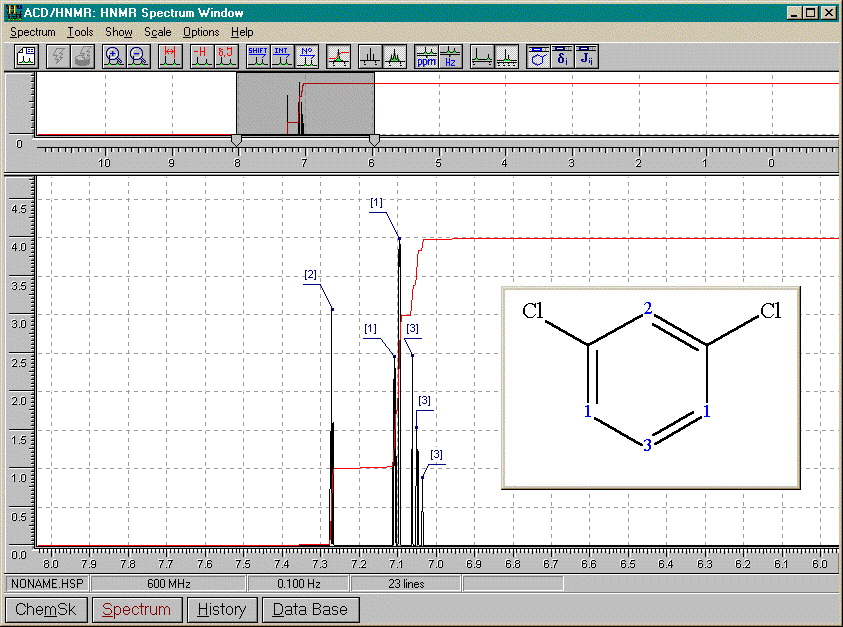
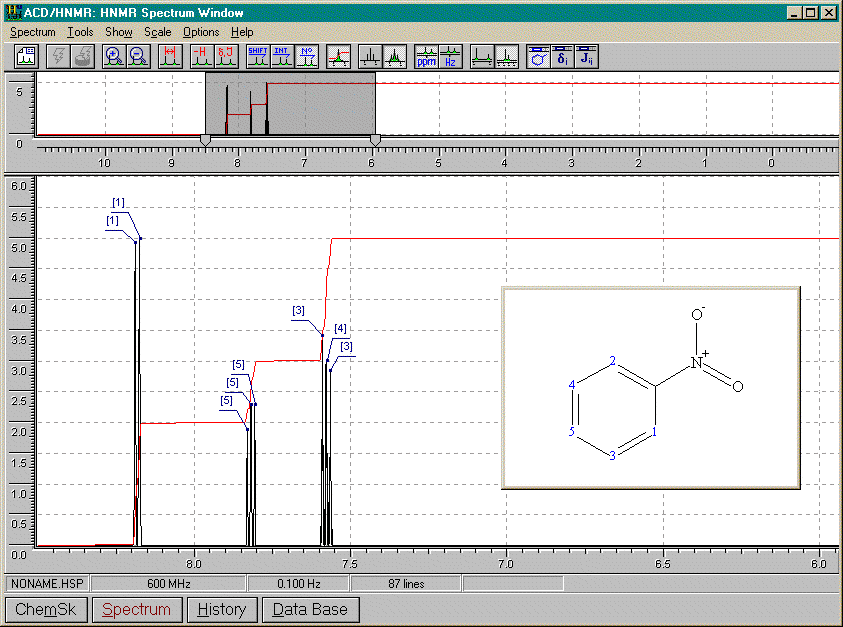
Nitrobenzène
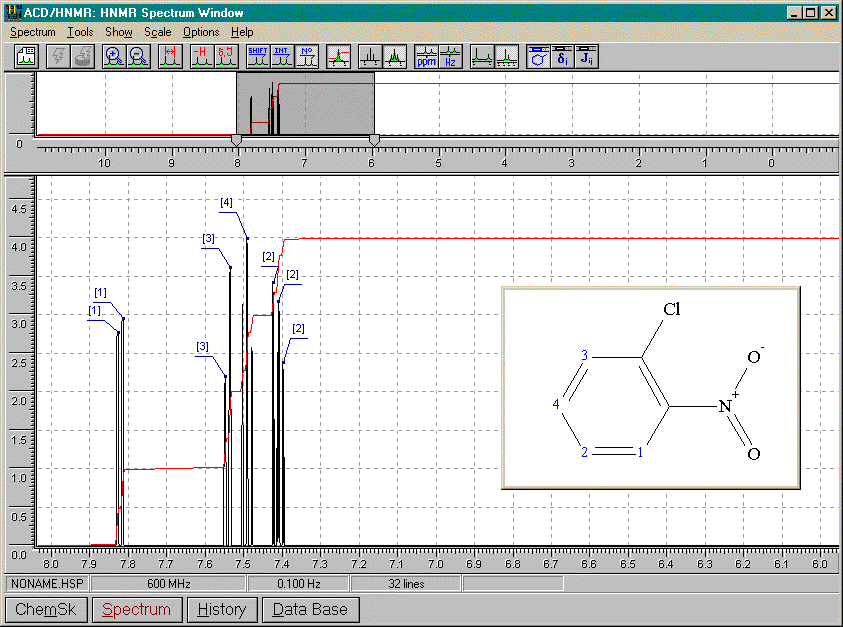
1-chloro-2-nitrobenzène
1-chloro-4-nitrobenzène(voir aussi 4-(N,N-diméthylamino)benzènecarbaldéhyde, Figure 15.10, Vollhardt p.561)
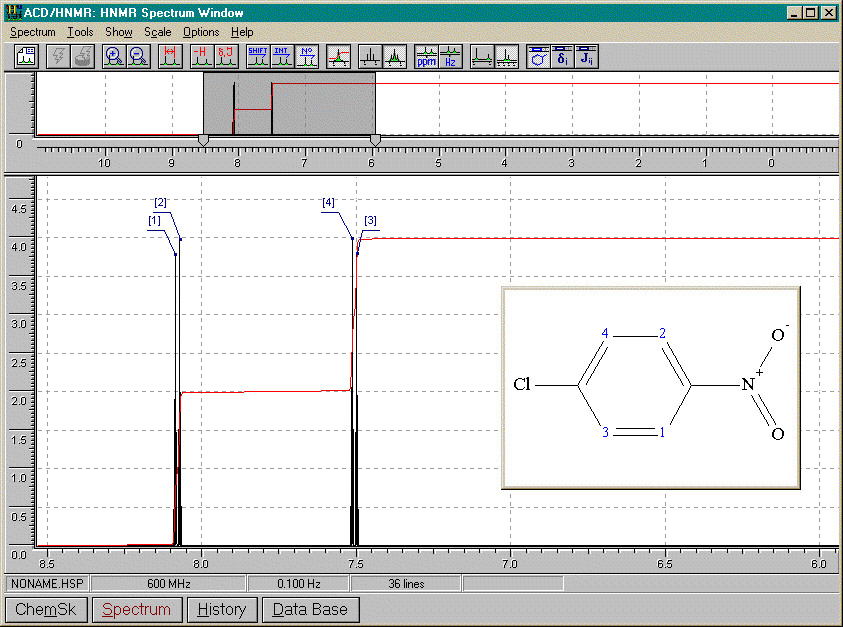
1-chloro-3-nitrobenzène
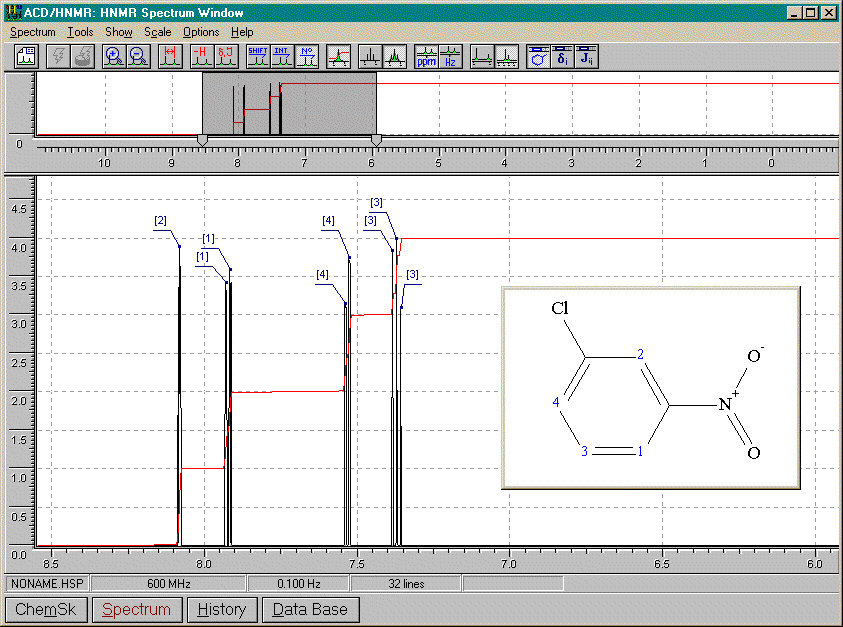
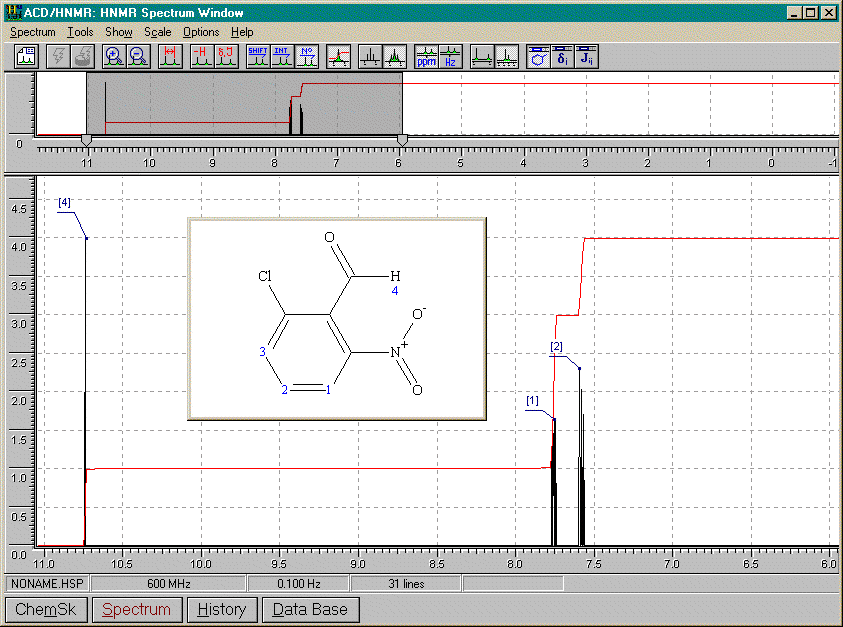
5-chloro-2-nitrobenzènecarbaldéhyde (ou 5-chloro-2-nitrobenzaldéhyde) (voir aussi 1-méthoxy-2,4-dinitrobenzène, Figure 15.11, Vollhardt p.562)
De tous les spectres précédants, nous pouvons conclure que:
A) 2 substituants identiques
ortho
2 doubletsméta
1 singulet (A=1) pour le proton entre les substituants1 doublet (A=2) pour les protons immédiatement à côté des substituants et couplés avec le proton en méta de ceux-ci
1 triplet (A=1) pour le proton en méta des substituants et couplé avec ses 2 voisins
para
1 singulet (A=4)B) 2 substituants différents
ortho
multiplet complexeméta
1 singulet (A=1) pour le proton non couplé entre les substituants1 multiplet complexe (A=3) pour les protons immédiatement à côté des substituants et couplés avec le proton en méta de ceux-ci
para
2 doublets (A=2 chacun) car 2 couples de protons différents. Analogue à 2 substituants identiques en ortho, mais les doublets sont moins distincts (d plus semblables)9.3.3. Réactivité (Vollhardt chapitres 15 et 16, Arnaud 12-2)
Les points essentiels caractérisant la structure électronique particulière du cycle benzénique sont:
• Les 3 doublets
• Cette délocalisation parfaitement symétrique procure au benzène une stabilité exceptionnelle.
La conséquence est que les réactions qui détruisent cette structure sont très défavorisées par rapport à celles qui la conservent, ou qui la restaurent après une destruction temporaire.
9.3.4. État naturel (Arnaud 12-3)
Le cycle benzénique est très fréquent dans une foule de molécules naturelles. Toutefois, les hydrocarbures benzéniques sont beaucoup plus rares. On les retrouve dans certains gisements pétroliers, notamment en Indonésie.
9.3.5. Préparations (Arnaud 12-4)
On obtient les termes simples (benzène, toluène, xylènes) industriellement par distillation du pétrole et par pyrogénation de la houille (traitement par la chaleur). Les autres termes s’obtiennent par synthèse.
9.3.6. Termes importants et utilisations (Arnaud 12-5)
Le benzène est de loin le plus important des hydrocarbures benzéniques. Il est à la base de très nombreuses matières plastiques, résines, colorants, détergents, insecticides, explosifs et textiles. Aux États-Unis, on en produit annuellement 6 milliards de litres
Mais le benzène est toxique et cause des maladies du foie. Les arènes à plusieurs noyaux accolés (tel le pyrène) sont hautement cancérigènes.
9.4. Benzènes substitués (Vollhardt 15, 16 et 22, Allinger 11.2)
Les alkylbenzènes portent souvent des noms triviaux, tel que démontré dans Favre 6.2.1. Mentionnons principalement le toluène et le styrène, de même que les xylènes (diméthylbenzènes) et les crésols (méthylphénols) (Favre 7.2.1).
Les structures montrées à la page 551 (Vollhardt) montrent quelques-uns de ces noms triviaux.
Il est à noter que la famille des cycles benzéniques substitués est celle qui possède le plus grand nombre de noms conservés. Ils sont décrits dans Favre, et il est suggéré à l’étudiant de s’y référer pour s’assurer de ceux qui peuvent être substitués.
Il importe toutefois de bien retenir les groupements suivants:
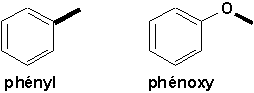
9.4.1. Phénols (Vollhardt 22.3 Arnaud 16)
Les phénols sont caractérisés par un groupement hydroxyle sur un cycle benzénique et ont la représentation Ar—OH:
Il faut se rappeler que la fonction —OH se doit d’être portée par le cycle benzénique pour être un phénol. Ainsi, le phénylméthanol (connu sous le nom d’alcool benzylique) n’est pas un phénol, mais bel et bien un véritable alcool.
Les structures présentées à la page 869 (Vollhardt) montrent quelques-uns des noms triviaux sous lesquels les phénols les plus courants sont connus. D’autres sont décrits dans Favre, et il est suggéré de vous y référer pour s’assurer de ceux qui peuvent être substitués.
9.4.1.1. Caractères Physiques (Arnaud 16-1)
Presque tous les phénols sont solides à la température ordinaire. Tout comme les alcools, ils sont le siège de liaisons hydrogène. Les premiers termes sont légèrement solubles dans l’eau. Finalement, ils possèdent généralement une odeur forte.
9.4.1.2. Réactivité (Vollhardt 22.4-5, Arnaud 16-2)
Étant donné que la fonction alcool est reliée directement sur le cycle benzénique, il en résulte une modification réciproque de la réactivité du groupe C—OH (par rapport aux alcools) et de celle du cycle (par rapport aux hydrocarbures benzéniques).
La rupture de la fonction —OH est facilitée, car la charge négative est supportée par le cycle benzénique par résonance:
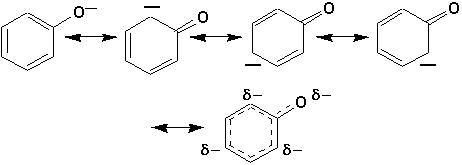
C’est aussi ce qui explique que la liaison C—O soit ici si difficile à briser, pour ne pas dire impossible.
Lorsque mis en solution dans l’eau, les phénols ont tendance à donner des phénolates.
ArOH + H2O ![]() ARO
ARO
À cause de la stabilisation de l’ion phénolate par résonance, l’équilibre est fortement déplacé vers la droite et les solutions possèdent un caractère plus acide que celui des alcools (8-10 vs 16-18).
Ainsi, à cause de son effet fortement activant, la fonction —OH orientera les réactions de substitution dans les positions ortho et para d’elle même. Par exemple, il est très facile d’obtenir par nitration le 2,4,6-trinitrophénol (acide picrique), mais tout à fait impossible de continuer au-delà de la triple nitration. Dans cette molécule, l’hydrogène est tellement labile, qu’il se comporte comme un hydrogène acide (pKa=0.25, comparé à un pKa d’environ 10 pour le phénol).
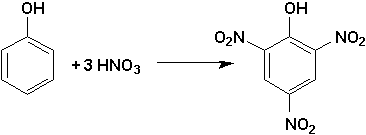
Certaines réactions autrement impossibles sont possibles sur le cycle benzénique, comme par exemple la réaction des hydrogènes ortho et para du phénol avec le formaldéhyde qui conduit à des produits de haut poids moléculaire, les résines thermodurcissables comme la Bakélite (Figure du milieu, Vollhardt p.883), possédant une grande complexité tridimensionnelle.
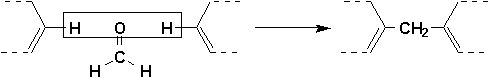
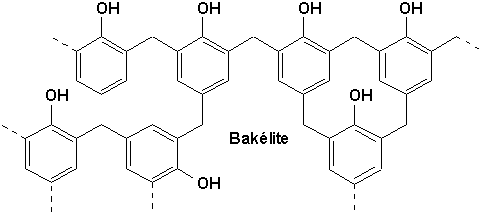
9.4.1.3. État naturel (Arnaud 16-3)
De nombreux phénols se retrouvent à l’état naturel dans les végétaux dont ils sont souvent des constituants très odoriférants:
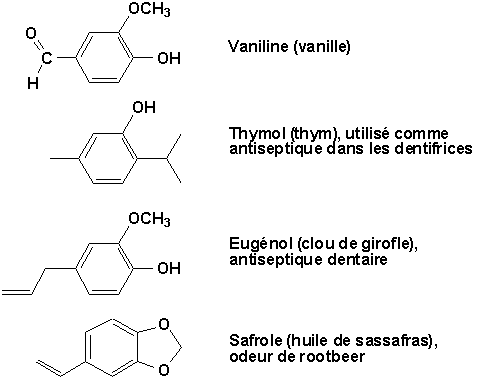
Certains même possèdent des effets physiologiques importants:
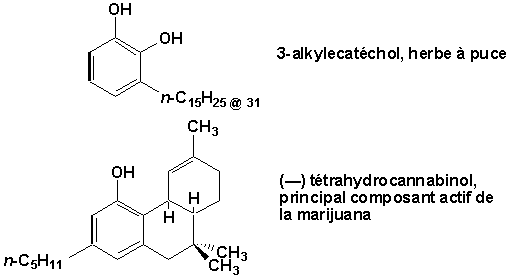
9.4.1.4. Termes importants et utilisations (Arnaud 16-5)
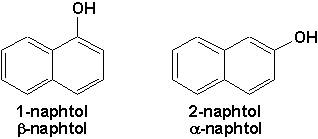
Le "phénol ordinaire" (C6H5OH) est le seul phénol vraiment important sur le plan industriel. La production mondiale est d’environ 1,5 million de tonnes, et ses utilisations sont très diverses: résines thermodurcissables du type phénol-formaldéhyde, textiles synthétiques de la catégorie des polyamides (nylons), colorants, herbicides, fongicides et germicides. Les naphtols, phénols dérivant du naphtalène sont également utilisés dans la synthèse des colorants.
|
Encarts des chapitres 15, 16 et 22 |
9.4.2. Les composés carbonylés (Allinger 11.2)
Parmi les plus connus, citons:
| benzaldéhyde (amandes amères) |
f—CHO |
| acide benzoïque | f—COOH |
| acétophénone | f—CO—CH3 |
| benzophénone | f—CO—f |
| cinnamaldéhyde (cannelle) |
f—CH=CH—CHO |
| vanilline | 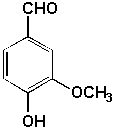 |
9.4.3. Les amines benzéniques (Vollhardt 21.1, Allinger 11.2)
Les amines benzéniques Ar—NH2 sont des liquides visqueux, ou des solides, insolubles dans l’eau et à l’odeur désagréable.
Le premier terme de la série, le benzamine porte aussi le nom d’aniline. L’aniline et les toluïdines (méthylanilines) sont les matières premières de l’industrie des colorants.
Les amines benzéniques Ar—NH2 sont beaucoup moins basiques que les amines saturées. La constante d’acidité du couple ArNH3+/ArNH2 vaut environ 10-5 (pKa = 5). Elle est donc 105 fois plus grande que les amines saturées. L’explication de ce phénomène origine de la délocalisation efficace du doublet libre de l’azote sur le système des électrons
p du cycle benzénique.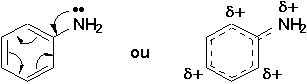
D’une part la densité électronique sur l’azote s’en trouve réduite, et le déficit (
d+) favorise la déprotonation. D’autre part la protonation de l’azote supprime la possibilité de délocalisation du doublet libre, qui se trouve "immobilisé" sous la forme d’un doublet s dans la nouvelle liaison N—H. L’acide conjugué ArNH3+ est donc moins stabilisé par résonance que la base ArNH2, et de ce fait sa formation est énergétiquement défavorisée.Il existe plusieurs amines possédant une forte activité physiologique. Les structures de l’encart 21.1 (p.825) en montrent quelques-unes. Plusieurs possèdent une structure importante; le squelette de la
b-phényléthylamine: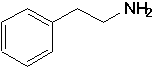
9.5. Note de nomenclature (Allinger 11.2)
Lorsque deux cycles benzéniques sont présents dans une molécule, ils sont distingués par des "primes" qui sont ajoutés aux indices des substituants de l’un des cycles.
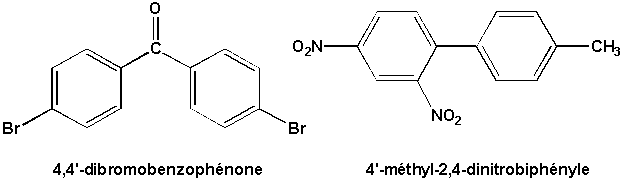
9.6. Le biphényle et ses dérivés (Allinger 11.5)
La molécule de biphényle a été étudiée avec soin et on a trouvé qu’elle est formée de 2 cycles coplanaires dans le cristal, alors qu’en forme gazeuse, l’un des cycles est tourné de 42° par rapport à l’autre.
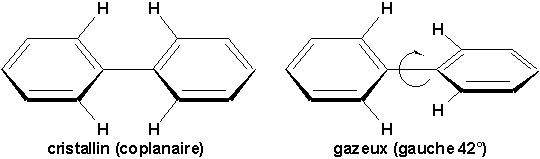
La résonance entre les deux cycles tend à rendre le système plan:
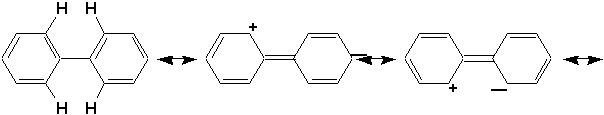
Mais dans cette géométrie les hydrogène ortho et ortho’ se trouvent à une distance inférieure à la somme de leurs rayons de van der Waals, ce qui explique la torsion observée en phase gazeuse jusqu’à un minimum d’énergie. Dans le cristal, les cycles sont coplanaires car cela maximise les forces d’attraction intermoléculaires de van der Waals entre les cycles et résulte en un cristal plus compact.
Lorsque ces hydrogènes sont remplacés par des groupements plus volumineux, la molécule ne peut adopter de conformation plane. De plus, la rotation autour de l’axe reliant les deux cycles est empêchée, car il faut alors passer par un intermédiaire coplanaire, ce qui est impossible:
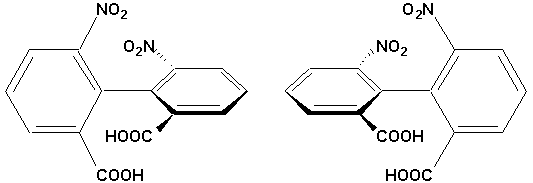
Un examen attentif des deux formes adoptées par le 2,2’-dicarboxy-6-6’-dinitrobiphényle indique que ce sont des énantiomères. Les groupes ortho volumineux empêchent l’interconversion des énantiomères, si bien qu’ils sont stables. La représentation suivante en donne un exemple d’un de ces deux énantiomère sur Chem3D Plus vu selon deux perspectives différentes (les hydrogènes ont été omis dans un but de clarté évidente).
9.7. Systèmes polycycliques (Vollhardt 15.5)
Les systèmes polycycliques sont ceux ou l’on accole des noyaux benzéniques côte à côte. Les structures présentées au milieu de la p.563 dans Vollhardt montre quelques-uns des cycles les plus importants. la nomenclature est décrite dans Favre, section 6.2.2.
Il en résulte un accroissement important du système
p, et donc d’un important déplacement bathochrome du maximum d’absorption du spectre U.V.-Visible (Figure 15.12, Vollhardt p.564).Toutefois, comme le démontrent les formes de résonance du naphtalène (Figure du milieu, p.564 et Figure 15.14, p.565, Vollhardt) la forme de la molécule n’est pas celle de deux hexagones parfaits. De plus, comme le démontre le spectre RMN-1H du naphtalène (Figure 15.15, Vollhardt p.565) il existe différents protons sur la molécule. Toutefois, la position des pics, de même que le comportement en RMN-13C (3 lignes à
d=126.5, 128.5 et 134.4 ppm) et en U.V.-Visible indiquent que le naphtalène est aromatique. Il en est de même pour les structures présentées à la page 563 (Vollhardt).Les Figures en bas de la p.566 (Vollhardt) montrent les formes de résonance de l’anthracène et du phénanthrène. le nombre de formes de résonance principales explique la plus grande stabilité du phénanthrène par rapport à l’anthracène.
Lorsque le nombre de noyaux condensés devient infini dans 2 directions, on obtient le graphite [Note]. Pris individuellement, chaque feuillet est solide, mais étant donné que les feuillets ne sont retenus entre eux que par des forces de van der Waals, ils peuvent facilement glisser les uns sur les autres. C’est ce qui justifie l’utilisation du graphite comme lubrifiant solide.
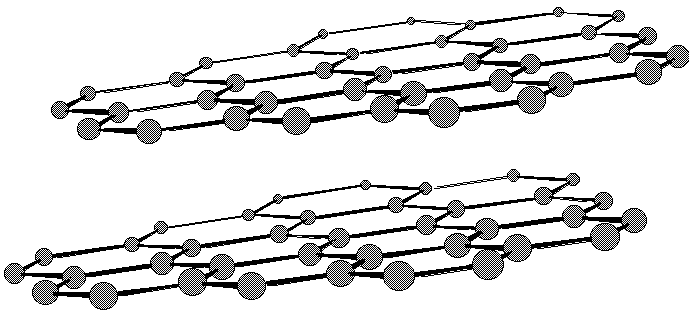
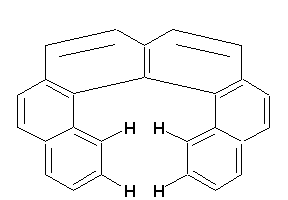
Il existe un cas particulier très intéressant, celui du phénanthro[3,4-c]phénanthrène (hexahélicène): on y retrouve 6 noyaux benzéniques accolés de manière angulaire et formant un cercle presque complet. Le nom d’hélicène vient du fait que la molécule est forcée d’adopter un arrangement hélicoïdal. Déboîtée, la molécule forme une hélice dont la spirale peut être dextrorse ou sinistrorse selon la direction du déboîtement. Cette structure peut être décrite par 3 plans. Chacun incorpore approximativement une entité naphtalène.
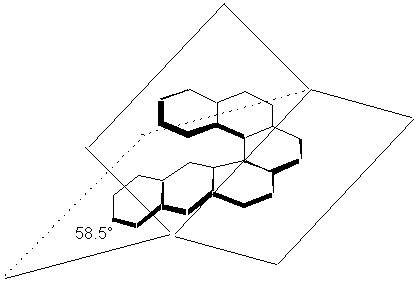
À cause de sa structure hélicoïdale, l’hexahélicène est chiral et ses énantiomères purs présentent des pouvoirs rotatoires spécifiques très élevés: [a]25°C = 3640°. On connait d’autres hélicènes supérieurs qui donnent lieu à des activités optiques encore plus prononcées. On remarquera que, bien que les hélicènes soient chiraux, ils sont cependant dépourvus de stéréocentres.
Enfin, il est important de noter que la houille est une excellente source d’hydrocarbures benzénoïdes. La houille est un polymère amorphe constitué de couches de composés aromatiques et hydroaromatiques polycycliques faiblement liés entre eux.
| Il est important de noter que TOUTES ces substances possèdent
une FORTE ACTION CANCÉRIGÈNE, spécialement ceux montrés
en bas de la p.617 (Vollhardt). L’étudiant est invité à lire le texte de la section 16.7 portant sur le potentiel carcinogène des hydrocarbures aromatiques polycycliques. |
9.8. Règle de Hückel (Vollhardt 15.7)
Question: les polyènes cycliques sont-ils tous aromatiques?
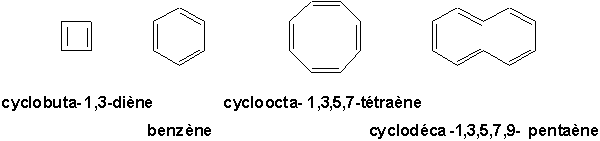
En mécanique quantique, un système aromatique possède une couche complète d’électrons
p.En 1931, Erich Hückel [Note] observa que la résolution de l’équation de Schrödinger du système
p d’un polyène monocyclique régulier et plan possède une orbitale de basse énergie, suivie de paires d’orbitales d’énergie croissante et finalement d’une orbitale de haute énergie. C’est ce qui est illustré à la Figure 15.17, (Vollhardt p.570). Les électrons p sont répartis comme indiqué à cette même figure.On peut voir que le cyclobuta-1,3-diène ne parvient pas à compléter une enveloppe fermée d’orbitales liantes. Par conséquent, il n’est pas considéré comme aromatique. Par contre, les 6 électrons
p du benzène lui permettent de réaliser une telle configuration.Prenons maintenant les cas du cycloocta-1,3,5,7-tétraène et du cyclodéca-1,3,5,7,9-pentaène présenté ci-dessous:
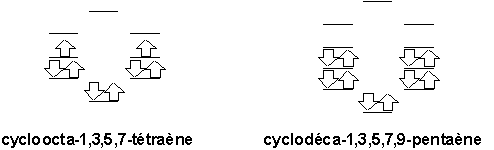
On voit que comme dans le cas du cyclobuta-1,3-diène, le cycloocta-1,3,5,7-tétraène ne parvient pas à compléter une enveloppe fermée d’orbitales liantes. Par conséquent, il n’est pas considéré lui non plus comme un aromatique. Par contre, les 12 électrons
p du cyclodéca-1,3,5,7,9-pentaène lui permettent de réaliser une telle configuration, tout comme le benzène.D’ailleurs, une étude des spectres RMN-
1H du cyclobuta-1,3-diène et du cycloocta-1,3,5,7-tétraène montre une résonance des protons vers d=5.7 ppm, ce qui est caractéristique des alcènes (déthène=5.64 ppm) et non des aromatiques (dbenzène=7.37 ppm). Quant à lui, le cyclodéca-1,3,5,7,9-pentaène résonne vers les même champs que le benzène.Hückel généralisa ses observations dans une règle simple:
"Si le nombre d’électrons
En suivant la règle de Hückel, les systèmes qui posséderont 6, 10, 14, 18, ... e
-p seront aromatiques.En 1956, Franz Sondheimer [Note] réalisa la synthèse du cyclooctadéca-1,3,5,7,9,11, 13,15,17-nonaène qui contient 18 e
- p. Pour éviter de traîner des noms aussi lourds, Sondheimer introduisit un système plus simple de nomenclature des polyènes conjugués cycliques. Il nomma les hydrocarbures monocycliques totalement conjugués (CH)N en tant que [N]annulènes, nom dans lequel N indique la taille du cycle.Dès lors, le cyclobuta-1,3-diène, le benzène, le cycloocta-1,3,5,7-tétraène et le cyclodéca-1,3,5,7,9-pentaène portent les noms de [4]annulène, [6]annulène, [8]annulène et [10]annulène. Le premier système aromatique non tendu dans cette série, après le benzène, est le [18]annulène (Figure du bas Vollhardt p.569). La molécule possède deux formes de résonance principales.
La règle de Hückel s’applique aussi aux molécules chargées.
Ainsi, par exemple le cyclopenta-1,3-diène est-il anormalement acide. La raison est que l’anion cyclopentadiényle possède un système délocalisé de 6 e-p dans lequel la charge négative est uniformément distribuée sur les cinq atomes de carbone du cycle (Figure du haut, p.571).| Notions importantes 4 à 6 dans Vollhardt p.587 Problèmes 5, 6, 7, 18, 19 aux pages 588 à 593 |
9.9. Hétérocycles aromatiques (Vollhardt chapitre 25)
Un hétérocycle est une chaîne cyclique comportant un ou plusieurs atomes autres que du carbone. On appelle alors cet atome un hétéroatome. Un composé hétérocyclique contient un ou plusieurs hétérocycles, pouvant être associés à des chaînes carbonées, cycliques ou acycliques.
Les hétéroatomes les plus courants sont l’oxygène, l’azote et le soufre. Les hétérocycles les plus stables sont ceux qui comportent 5 ou 6 atomes, comme les cycles carbonés.
Les composés hétérocycles simples ne se retrouvent pas à l’état naturel, mais les hétérocycles sont très fréquents au sein des produits naturels, comme par exemple les alcaloïdes. Plus de la moitié des composés naturels sont hétérocycliques et une portion très importante des médicaments contiennent des hétérocycles. Quelques exemples supplémentaires sont donnés dans Vollhardt p.989.
9.9.1. Nomenclature des hétérocycles (Vollhardt 25.1, Favre 6.3-6.4)
Cette nomenclature est complexe. On nomme le cycle en mentionnant l’hétéroatome comme préfixe en utilisant le système de Hantzsch-Widman (Tableau VI, Favre p.64) Nous ne mentionnerons que quelques cycles d’importance qui sont présentés à la p.990 dans Vollhardt.
Évidemment, les cycles à 3 et 4 membres seront très tendus, tout comme l’étaient les cycloalcanes. Nous ne nous attarderons que sur les cycles à 5 et 6 membres.
9.9.2. Hétérocycles à 5 atomes (Arnaud 21-1)
Les principaux hétérocycles à 5 atomes sont insaturés. Ils peuvent être répartis grosso modo en deux catégories:
Ceux qui comportent un hétéroatome:
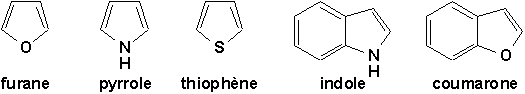
Ceux qui comportent deux hétéroatomes:
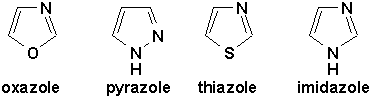
Il y en a aussi qui comportent plusieurs hétéroatomes, de même qu’il existe aussi des hétérocycles saturés:

9.9.2.1. Furane. Pyrrole. Thiophène: des hétérocyclopentadiènes aromatiques (Vollhardt 25.3)
À cause de la présence de doublet libre sur l’hétéroatome, ces 3 composés présentent une particularité intéressante: ces électrons non-liants participent avec les électrons
p des doubles liaisons à une structure conjugué qui est stabilisée par résonance et comportant un total de 6 électrons p, tout comme l’anion cyclopentadiényle (figures du milieu et 25.1, p.995 dans Vollhardt). Comme dans le cas du benzène, et plus généralement des composés aromatiques comportant 4n+2 électrons délocalisés (règle de Hückel), ces électrons occupent des orbitales moléculaires qui englobe la totalité du cycle.Ainsi cette stabilité aromatique procure au furane, au pyrrole et au thiophène une réactivité chimique comparable à celle du benzène: grande stabilité, difficulté des réactions d’addition, facilité des réactions de substitutions.
En outre, la présence d’un (ou de deux) doublet(s) libre(s) sur l’hétéroatome leur confère un caractère basique.
Enfin, l’hydrogène lié à l’azote du pyrrole est labile.9.9.3. Hétérocycles à 6 atomes (Arnaud 21-2)
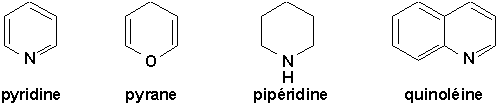
Voici quelques exemples de structures que l’on rencontre dans cette série:
Ceux qui comportent un hétéroatome:
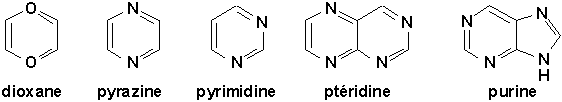
Ceux qui comportent deux hétéroatomes
9.9.3.1. Pyridine, un azabenzène (Vollhardt 25.5)
La pyridine ne se prépare pas. On l’extrait des goudrons de houille, qui contient également des méthylpyridines isomères (picolines). La pyridine est souvent utilisée comme solvant de réaction.
| MISE EN GARDE: la pyridine est néfaste surtout pour les hommes, car elle agit dans l’organisme au niveau de la testostérone. Manipuler toujours sous la hotte et avec beaucoup de précautions. |
À cause de sa structure plane, le doublet libre de l’azote ne participe pas aux structures de résonance du cycle (contrairement au pyrrole) (Figure 25.2, Vollhardt p.1001). Ceci confère à la pyridine un caractère basique (105 fois plus que le pyrrole). De plus, la base conjuguée résultant de la protonation de l’azote conserve son caractère aromatique.
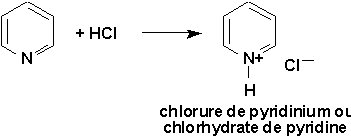
Les spectres RMN-
1H de la pyridine montrent bien son caractère aromatique (Figure du bas, Vollhardt p.1001).| L’étudiant est invité à lire l’encart 25.4 |
9.9.4. Alcaloïdes et autres produits biologiquement actifs (Vollhardt 25.8, Arnaud 21-3)
Les structures hétérocycles, principalement azotées, se retrouvent dans de nombreux composés naturels d’origine végétale appelés alcaloïdes.
En plus des structures de la morphine, de l’héroïne, de la quinine, de la strychnine et de la brucine montrées aux pages 1010 et 1011 (Vollhardt), citons:
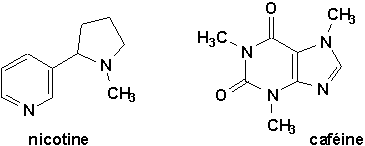
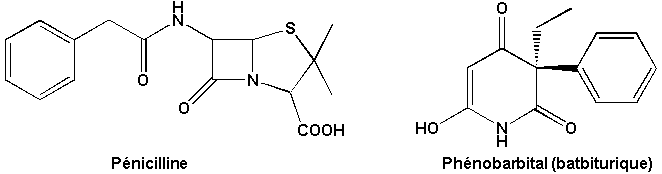
Enfin, de nombreux composés biologiquement actifs (antibiotiques, hypnotiques, etc.) possèdent également des éléments structuraux hétérocycliques.
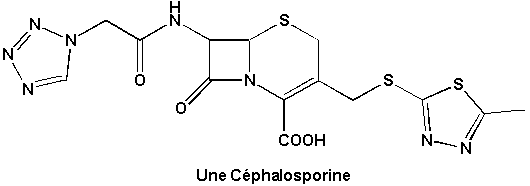
Enfin, une substance naturelle nouvellement découverte est douée de propriétés anticancéreuses pleines de promesses (Encart 25.2):
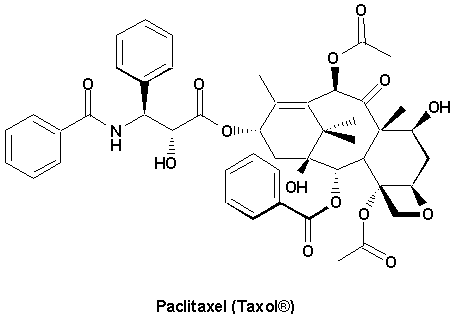
| Encarts du chapitre 25 Notions importantes 1, 3, 4, 5 à la p.1014 Problémes 1, 5, 6 des p.1014-1022 |
9.10 Exercices de nomenclature
Faire les exercices de nomenclature qui sont présentés dans Favre
Autres exemples: (réponses après les structures)
a) 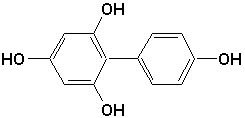 |
b) 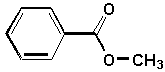 |
c) 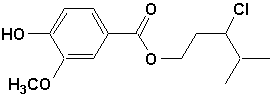 |
d) 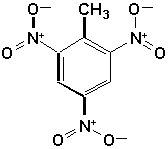 |
e) 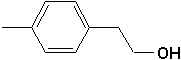 |
f) 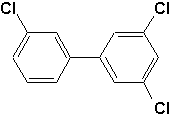 |
Réponses:
a) biphényl-2,4,4’,6-tétrol
b) benzoate de méthyle
c) 4-hydroxy-3-méthoxybenzoate de 3-chloro-4-méthylpentyle
d) 2,4,6-trinitrotoluène (TNT)
e) 2-(4-méthylphényl)éthanol
f) 3,3',5-trichlorobiphényle
| Retour au menu |
|
ABCSITE © copyright 2000 |