1.
LE SECOND PRINCIPE : PRINCIPE D’ÉVOLUTION
1.1. L’entropie S
Pour
tout système, il existe une fonction d’état extensive
l’entropie S, non conservative.
1.2. Bilan entropique
La
variation d’entropie DS
d’un système fermé entre deux instants successifs t1
et t2 s’écrit :
DS =
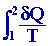 + Sp
avec Sp
³
0
+ Sp
avec Sp
³
0
Sous
forme différentielle :
dS =
 +
d
Sp
+
d
Sp
Où : dS représente la différentielle totale
exacte de la fonction d’état ;
dQ
et dSp
représentent des formes différentielles ;
T est la température
thermodynamique définie en chaque point de la surface et
correspond à la température absolue.
Le
premier terme
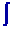 dQ
/ T correspond à l’entropie échangée Se
dQ
/ T correspond à l’entropie échangée Se
Le
second terme Sp correspond à l’entropie produite et le
système est alors le siège de phénomènes irréversibles
provenant :
-
de transferts de chaleur, de masse, provoqués par des hétérogénéités,
de température, de concentrations ;
-
de frottements mécaniques, de viscosité ;
-
de réaction chimiques, d’hystérésis.
L’unité
d’entropie est le joule par Kelvin : J/K
2.
CONSÉQUENCES
2.1. Différentes formulations
DS = Sp
³
0
DS
= 0
dS = dQ
rev / T
dS = 0
Une
transformation isentropique n’est pas toujours adiabatique réversible :
dQ
/ T + dSp
= 0
2.2. Autres formulations du second principe
-
Énoncé
de Clausius : La chaleur ne passe pas spontanément d’un
corps froid à un corps chaud.
-
Énoncé
de Kelvin : Un système décrivant un cycle monotherme ne
peut que recevoir du travail et fournir de la chaleur.
2.3. État d’équilibre et réversible
Le
second principe permet de préciser la définition de l’état
d’équilibre d’un système :
Un
système homogène se trouve dans un état d’équilibre par
rapport à un repère :
-
s’il est immobile : sa vitesse d’ensemble par
rapport au repère est nulle ;
-
si les variables d’état ne varient pas au cours du temps :
état stationnaire ;
Une
transformation est réversible si la création d'entropie Sp
est nulle
2.4. Identité thermodynamique
On
étudie souvent une masse de fluide globalement immobile et soumise
uniquement à des forces de pression. Pour une transformation
réversible :
dQ = T dS donc dU = T dS – p dV
Les
grandeurs qui interviennent dans cette équation sont des fonctions
ou des variables d’état :
Lors
d’une quelconque transformation infinitésimale d’un système
fermé soumis aux seules forces de pression :
dU = T dS – p dV
On
en déduit que U est une fonction de S et V et que S est une
fonction de U et V
dS = (dU
/ T ) + ( P / T)
Les
variables T et S forment un couple de variables conjuguées.
3. EXEMPLES DE BILAN
S
étant une fonction d’état, la variation d’entropie au cours
d’une transformation irréversible entre deux états d’équilibre
peut être calculée en utilisant le chemin entre ces deux états :
DS =
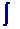 dQ
rev / T =
Se + Sp
dQ
rev / T =
Se + Sp
Les
calculs de l’entropie échangée Se puis de
l’entropie produite Sp
peuvent être réalisés :
-
si la transformation est réversible
:
DS
= Se et Sp est nulle ;
-
si la transformation est adiabatique
: Se
est nulle et DS
= Sp ;
-
si le système est en contact avec une source de chaleur qui fixe la
température de la surface du système à TS pendant la
transformation et donne au système la chaleur Q :
Se =
Q / TS et Sp
= DS
– Se.