|
Chapitre
3:
COEFFICIENTS
THERMO ÉLASTIQUES ET CALORIMÉTRIQUES
|
1.
COEFFICIENTS THERMOELASTIQUES
1
1-1. Définitions
a
= 1 / V
 en K-1
en K-1
b
= 1/ P
 en
K-1
en
K-1
- isotherme : cT
= - 1/V
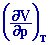 en
Pa-1
en
Pa-1
- isentropique : cS
= - 1/V
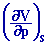 en
Pa -1
en
Pa -1
1.2 Relation entre coefficients thermo élastiques
cT
= =
g
cS
(relation de Reech) a
= pbcT
2.COEFFICIENTS CALORIMÉTRIQUES
On
étudie un fluide, système fermé monophasé, qui est défini par
sa pression p, son volume massique n
et sa température T. Ce système sera appelé système (p, n,
T). Ces variables sont reliées par une équation d’état :
f (p, n,
T) = 0
Deux
variables seulement sont indépendantes : le système est divariant :
Cette
équation d’état peut se présenter également sous les trois
formes :
p = p (n,
T) n
= n
(p, T) T = T (n,
p)
Pour
une transformation élémentaire quasi statique d’un système (p, n,
T), la chaleur élémentaire par unité de masse dQ
s’écrit en fonction de deux variables indépendantes :
δ Q = cn
dT + ldn
δ Q = cp dT + hdp
δ Q = l
dp + mdn
Ces
relations introduisent six coefficients calorimétriques.
La
variation élémentaire de l’énergie interne relative à l’unité
de masse s’écrit :
du = cn
dT + (l – p) dn.
La
variation élémentaire dh d’enthalpie relative à l’unité de
masse s’écrit :
dh = cp dT +
(h + n)
dp.
cn
= (T, n)
=
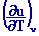
cp = (T, p) =
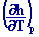
Cn,m
= M cn
et
cp,m =
M cp en J. mol – 1
K -1.
Cn
= m cn
et Cp
= m cp
en J.K-1
On pose
g = Cp
/ Cv
3.
RÉSULTATS EXPÉRIMENTAUX
3.1 . Capacités calorifiques des solides
Les
solides subissent de faibles variations de volume ce qui permet de
parler généralement de la capacité calorifique c massique d’un
solide :
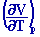 =
0 Þ
l =
0 Þ cp = cv =
c.
=
0 Þ
l =
0 Þ cp = cv =
c.
La
capacité calorifique d’un solide augmente avec la température.
Au
dessus d’une certaine température, la capacité calorifique
molaire Cm des solides reste pratiquement constante :
Cm = 3 R »
25 J.K -1 mol -1 (loi Dulong et Petit)
Avec
R la constante des gaz parfaits.
A
température ordinaire, cette loi est assez bien suivie par les
solides purs usuels.
3.2. Capacités calorifiques des liquides
Comme
les solides, les liquides subissent de faibles variations de volume
ce qui permet de parler généralement de la capacité calorifique c
massique d’un liquide.
La
capacité calorifique d’un liquide augmente avec la température.
La
capacité calorifique massique c de l’eau a la valeur la plus élevée :
c
= 4 187 J.K -1 kg-1 à température
ordinaire.
Les
liquides organiques comme l’éthanol ont une capacité calorifique
massique d’environ 2 500 J.K – 1 kg-1
à température ordinaire.
3.3 Capacités calorifiques des gaz
Pour
les gaz monoatomiques comme les gaz rares, on trouve à température
ordinaire des capacités calorifiques molaires telles que :
Cp, m = M cp
= 5/2 R = 20,8 J.K – 1 mol -1
Cv,
m = M cv =
3/2 R = 12,5 J.K – 1 mol -1
g
= 5/3 = 1,66
Pour
les gaz diatomiques comme le dihydrogène, le diazote, le dioxygène,
on trouve à température ordinaire des capacités calorifiques
molaires telles que :
Cp, m = M cp
= 7/2 R = 29,1 J.K – 1 mol -1
Cv,
m = M cv =
5/2 R = 20,8 J.K – 1 mol -1
g
= 7/5 = 1,4
|